Leclanchéova baterie
Leclanchéova baterie je baterie systému oxid manganičitý zinek (MnO2-Zn) s mírně kyselým elektrolytem s převahou NH4Cl (chlorid amonný - salmiak). Jedná se o první, masově vyráběný druh chemického zdroje elektrické energie.
Elektrochemický děj probíhající při vybíjení je možné vyjádřit následující rovnicí:
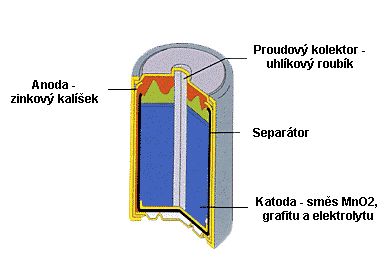
10.2 Zjednodušená konstrukce článku MnO2-Zn s mírně kyselým elektrolytem
Kladná elektroda je tvořena směsí MnO2 (přírodní nebo elektrolytický burel), grafitu, sazí a elektrolytu (NH4Cl s přísadou ZnCl2). Anodu tvoří zinkový kalíšek, který má na dně a vnitřní válcové stěně vložen separátor (obvykle papír se zvýšenou mechanickou pevností). Nevýhodou tohoto uspořádání je to, že kovová zinková anoda, která současně tvoří nádobu článku, se během vybíjení může nerovnoměrně (lokálně) rozpouštět a tak může dojít k předčasnému vytékání elektrolytu. K zamezení tohoto jevu, býval do separátoru přidáván vysoce toxický chlorid rtuťnatý, jeho stykem se zinkem došlo k vyredukování kovové rtuti a vytvoření vrstvy rtuťové amalgamy na vnitřních stěnách zinkového kalíšku, která bránila vzniku lokální koroze. Tento postup je dnes zakázán, bohužel se s ním můžeme setkat u nelegálních (občas i u oficiálních) dovozů východoasijských baterií. Jako proudový kolektor slouží uhlíkový roubík, který je vlisován do katodové směsi. Článek je obvykle uzavřen proti vysychání vody z elektrolytu asfaltovou zálivkou. Uhlíkový roubík je mírně porézní, proto není článek zcela hermeticky uzavřen, to umožňuje vyrovnávat přetlak, který v článku může vznikat vodíkovou korozí nebo vývojem plynného čpavku. Aby nedocházelo k vzlínání elektrolytu k mosazné čepičce (+ pól článku), kterou je uhlík ukončen, jsou jeho stěny pokryty tenkou vrstvou parafinu. Do elektrolytu je přidáván chlorid zinečnatý (ZnCl2), který slouží k vázání čpavku (NH4) za vzniku komplexní rozpustné sloučeniny chloridu tetraamozinečnatého [Zn(NH3)4 ]Cl2 . Vznik tohoto rozpustného produktu způsoboval, spolu s výše zmíněným nerovnoměrným rozpouštěním zinkové anody, časté vytékání elektrolytu, který mohl zničit spotřebič.
Proto jsou většinou výrobců Leclancheovy články nahrazovány bateriemi systému oxid manganičitý zinek s mírně kyselým elektrolytem s převahou chloridu zinečnatého, označovanými jako zinkochloridové články.
Diskuze ke stránce Leclanchéova baterie
Luděk Stehlík: Re: CHYBA?
Přeji dobrý den, není zde chyba. Anoda je elektroda na které dochází k oxidaci aktivní hmoty, katoda je elektroda, na které je aktivní hmota redukována.
Anodická reakce je tedy oxidace a katodická reakce je redukce.
U primárních článků je anoda zápornou elektrodou a katoda elektrodou kladnou.
Poněkud složitější je to u akumulátorů, kde při nabíjení probíhá na kladné elektrodě oxidace, tedy anodický děj a tak je kladná elektroda v průběhu nabíjení anodou, ale během vybíjení dochází na téže elektrodě k redukci, je tedy tatáž elektroda katodou. Obdobně záporná elektroda je při nabíjení katodou a při vybíjení anodou. Proto z praktických důvodů se pro označení elektrod akumulátorů používají pouze výrazy kladná elektroda a záporná elektroda, protože označení katoda a anoda je bez udání směru průtoku proudu (nabíjení či vybíjení) nejednoznačné.
reagovat 12. 3. 2013 07:43:25 


 -10
-10
 Abeceda baterií a akumulátorů
Abeceda baterií a akumulátorů
Bára: CHYBA?
Dobrý den, nemáte v textu chybu?
KLADNÁ elektroda je tvořena směsí MnO2 (přírodní nebo elektrolytický burel), grafitu, sazí a elektrolytu (NH4Cl s přísadou ZnCl2). ANODU tvoří zinkový kalíšek,
nemá to být "katoda" místo kladná elektroda? protože kladná elektroda = anoda a potom to nedává smysl.
reagovat 11. 3. 2013 19:57:32


 +7
+7